Forstå viktigheten av kompresjonsterapi i VTE-forebygging
Når vi får et lite sår, verdsetter vi blodets evne til å koagulere for å beskytte såret og hindre ytterligere blodtap. Men når blodet begynner å koagulere på feil sted på feil tidspunkt, kan konsekvensene være livsendrende, til og med dødelige. Hvert år forårsaker blodkoagler i de dype venene omfattende lidelser for millioner av mennesker. I denne artikkelen tar vi en nærmere titt på blodpropper, årsakene til dem og hvordan Flowtron aktivt kompresjonssystem kan bidra til å forebygge tilstanden.
«Det anslås at det oppstår ti millioner tilfeller av blodpropp (VTE) per år over hele verden. Det er en livstruende tilstand som kan medføre en betydelig kostnadsbyrde for helsevesenet», sier Henrik Runnerström, Global Director i Product Category Management, VTE Prevention hos Arjo.
Ca. 30 prosent av pasientene dør innen 30 dager etter utvikling av VTE, mens 25 prosent av uventede pasientdødsfall blir diagnostisert med lungeembolisme ved obduksjon1.
Omtrent en tredjedel av pasientene med dyp venetrombose (DVT) utvikler posttrombotisk syndrom, en tilstand som forårsaker lidelser, hevelser og smerter1. For 25 prosent av disse pasientene2 er den resulterende kroniske sårdannelsen forbundet med betydelige løpende behandlingskostnader3.
Henrik fortsetter: «I tillegg til alle de menneskelige lidelsene, innebærer det høye antallet VTE-tilfeller en betydelig kostnadsbyrde for helsevesenet.»
Hva er VTE?
Venøs tromboembolisme (VTE) er en samlebetegnelse som omfatter dyp venetrombose (DVT) og lungeembolisme (LE). DVT er en blodpropp i en dyp vene, vanligvis i benet, mens en LE kan forekomme hvis blodproppen løsner og føres med blodstrømmen til lungene og blokkerer blodtilførselen helt eller delvis.
Lungeembolisme er en potensielt dødelig tilstand4. Selv om tidlig identifisering og behandling av VTE kan lede til bedring, kan langsiktige komplikasjoner føre til livslang behandling og lidelse.
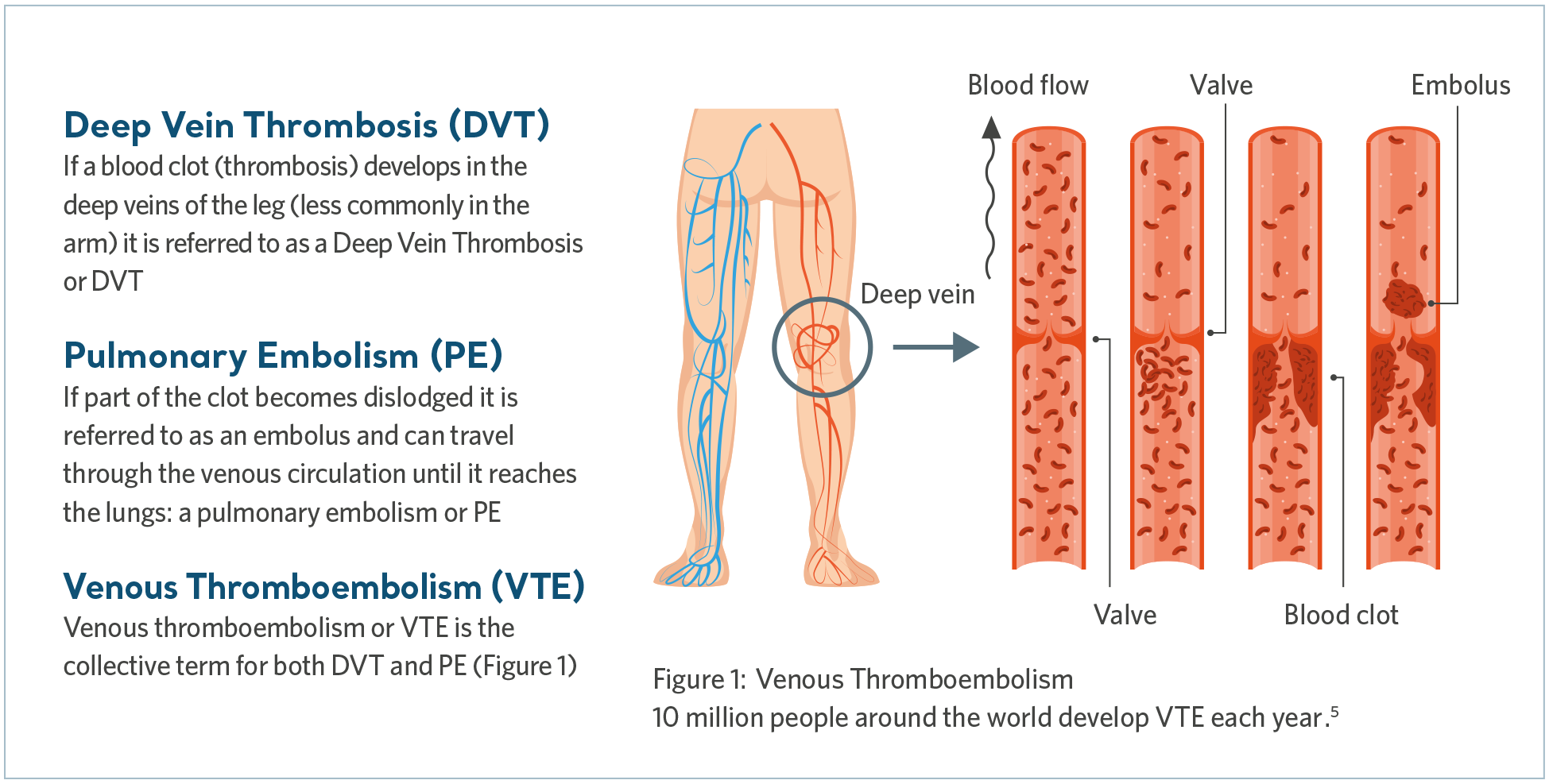
Hva forårsaker VTE?
VTE utløses når flere risikofaktorer, som samlet beskrives som «Virchows triade», forstyrrer balansen i homeostasen og fører til dannelse av en blodpropp.6 La oss se på hvert av elementene som utgjør Virchows triade.
Virchows triade
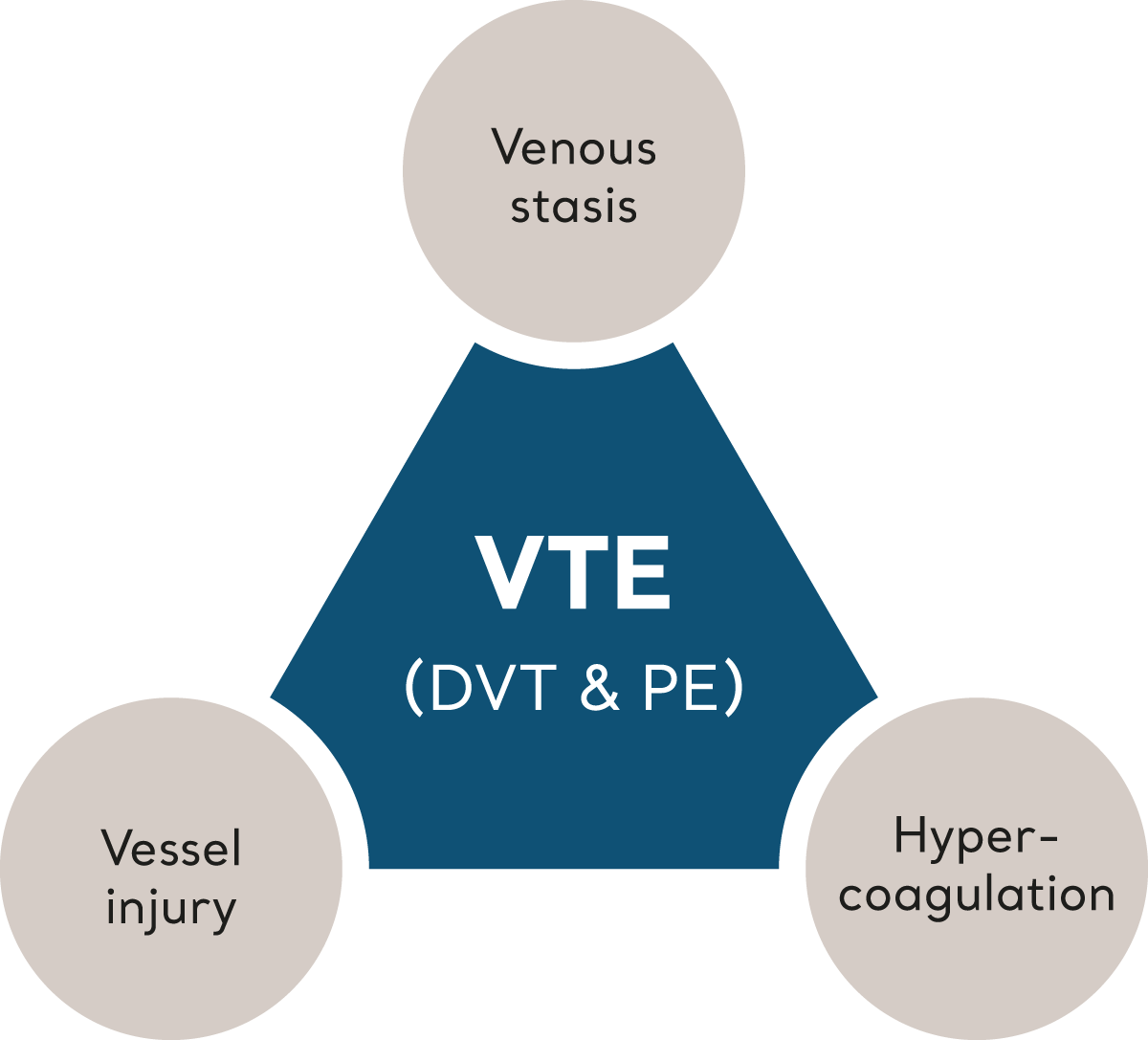
Venestase
Forhold som får blodstrømmen til å gå langsommere (stase) i de dype venene, vil øke risikoen for VTE. Immobilitet, kanskje på grunn av alder, skjørhet eller foreskrevet sengeleie, er en klar risikofaktor.
Fysisk obstruksjon av de dype blodkarene, enten på grunn av ytre påvirkning eller press fra svulster og lymfeknuter, er også nevnt, og det samme gjelder tidligere DVT-er.
Hyperkoagulering
Endringer i blodets tetthet og kjemi kan øke tendensen til blodpropp. Dette er forbundet med tilstander som enkel dehydrering til hypoksi, malignitet, traume, hormonbehandling, systemisk inflammatorisk sykdom og genetisk predisposisjon.
Skade på blodkar
Skade kan oppstå gjennom utilsiktet traume eller som en konsekvens av medisinske inngrep, slik som kirurgiske eller invasive prosedyrer. Når skaden oppstår, starter en normal fysiologisk serie med hendelser som fører til adhesjon av blodplatene og til slutt dannelse av en blodpropp. Denne beskyttelsesmekanismen avgrenser skaden og starter tilhelingsprosessen. Noen ganger blir imidlertid denne prosessen overdrevet.
Hvem har risiko for VTE?
Kirurgiske pasienter er en spesiell risikogruppe7 da selve operasjonen gir størst risikoøkning på grunn av anestesi (hyperkoagulabilitet), muskelrelaksantia (stase) og kirurgisk intervensjon
(skade på blodkar). Det er også tydelig at ikke-kirurgiske sykehuspasienter har høy risiko for VTE.
Henrik Runnerström sier: «Det er mange faktorer som bidrar til VTE, og selv om tilstanden ofte er forbundet med immobile mennesker og eldre, kan den også forekomme hos tilsynelatende friske personer som er i god form.»
Den tidligere elitehockeyspilleren Stefan Elvenes i Sverige er et eksempel på dette. Noen måneder etter at han pensjonerte seg fra ishockey – etter en 22 år lang karriere på høyeste nivå i Sverige og Danmark – merket han en hevelse bak på det venstre benet.
«Da legen fortalte meg at det var en blodpropp, kunne jeg ikke tro det. Jeg var bare 37 år gammel, og i svært god form. Jeg skulle ikke få noe slikt», sier Stefan.
Etter å ha blitt fortalt at yngre og atletiske personer også kan få blodpropper, ble Stefan behandlet med blodfortynnende midler. Men tre uker etter at han sluttet å ta medisinen, fikk han et alvorlig panikkanfall.
«Jeg hadde i bakhodet at avslutning av medisineringen kunne innebære risiko for å få en ny blodpropp. Det var sannsynligvis dette som utløste panikkanfallene mine», sier Stefan. «Jeg var et mental vrak i lang tid. Men regelmessig behandling hos psykolog hjalp meg å bli kvitt frykten. I dag har jeg slått meg til ro med det.»
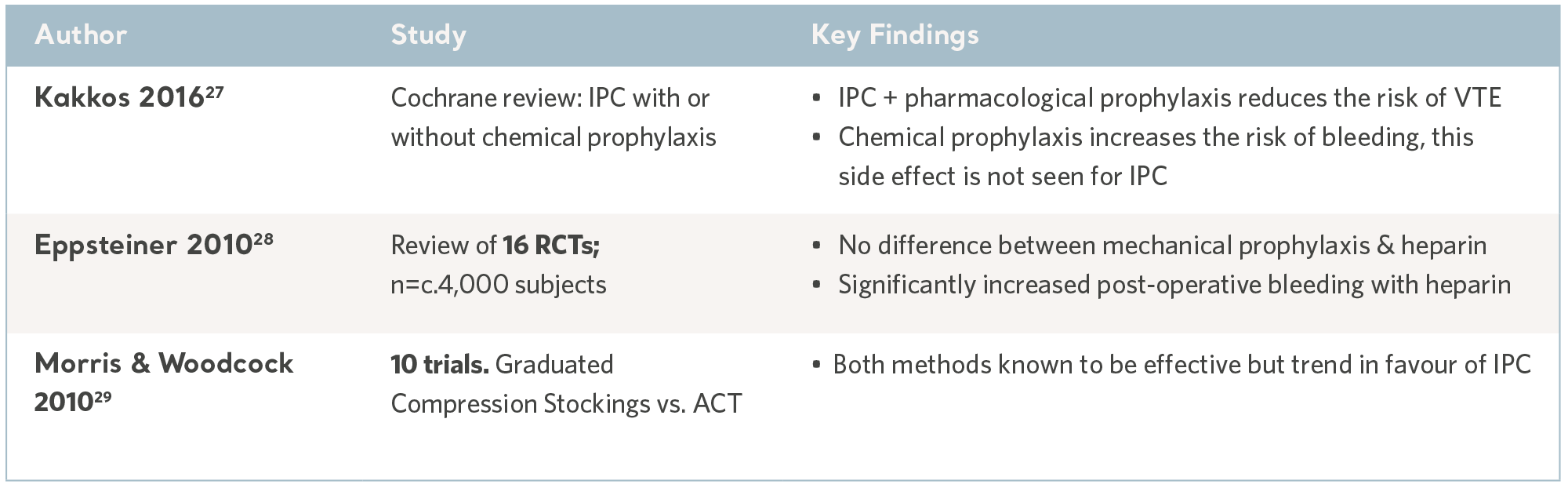
Forebygging av VTE
Farmakologisk profylakse, som blodfortynnerne Stefan ble behandlet med, er én måte å håndtere VTE på. Forebyggende strategier omfatter også ulike mekaniske metoder, for eksempel intermitterende pneumatisk kompresjon (IPC) og passive graderte kompresjonsstrømper (GCS).
IPC er en svært veletablert og dokumentert intervensjon med en overbevisende evidensbase og få bivirkninger – og den er indisert for bruk på en lang rekke sykehuspasienter med risiko for VTE.
Formålet med IPC er å drive blodet fra de dypere venene gjennom periodisk oppblåsing og tømming av en mansjett som er koblet til en elektrisk pumpe.
Som en ikke-invasiv mekanisk metode for VTE-profylakse, er IPC effektiv når det brukes enten som et enkeltstående forebyggende tiltak, for eksempel for pasienter med høy risiko for blødning. Det brukes også svært ofte i kombinasjon med farmakologisk profylakse for høyrisikopasienter (for å redusere risikoen for VTE ytterligere).
En pålitelig samarbeidspartner for bruk av IPC innenfor forebygging av VTE
Siden 1970-tallet har studier om VTE tydelig vist den gunstige effekten som er forbundet med IPC i de dype venene i benet. Siden den gang har Arjo vært en viktig aktør innen utviklingen av brukervennlige og klinisk effektive IPC-systemer for å støtte institusjoner over hele verden. Produktene i Flowtron Active Compression System (ACS) er utviklet for å håndtere klinisk effektivitet gjennom komfort, brukervennlighet og kostnadseffektivitet.
Arjo er også opptatt av å forbedre pleiekvaliteten for pasienter og hjelpe helsepersonell med å bekjempe dyp venetrombose og lungeembolisme.
«Vårt engasjement går utover det å levere pumpene og mansjettene som inngår i vårt Flowtron Active Compression System. Vi ønsker å differensiere Arjo fra konkurrentene ved å være en samarbeidspartner som også tilbyr tjenester og verdifull kunnskap», sier Henrik Runnerström.
Han fortsetter: «Selv om helsepersonell er klar over risikoene, kan det hende at de ikke har nok tid, opplæring eller ressurser til å optimalisere forebyggende tiltak. Å forstå disse utfordringene danner grunnlaget for utviklingen av våre tjenester og opplæringsprogrammer, som er utviklet for å styrke kapasiteten til å forebygge og behandle VTE.»
Flowtron aktivt kompresjonssystem – en ekte plug-and-play-løsning
Arjos løsning, Flowtron Active Compression System, bruker en pneumatisk pumpe til å blåse opp mansjetter rundt foten, leggen, eller låret, eller en kombinasjon av de tre.
Henrik sier: «Ved å etterligne virkningen av muskel-vene-pumpen i leggmuskelen, øker IPC blodsirkulasjonen i de dype venene og bidrar til å hindre at blodet koagulerer. Det er en veletablert og dokumentert behandling med en overbevisende evidensbase.»

Flowtron ACS900-pumpen (bildet ovenfor) gir både ensartet og sekvensiell kompresjon via en rekke ulike mansjettyper. SmartSenseTM automatisk mansjettgjenkjenning (bildet nedenfor) sammen med enknappsstart gjør Flowtron til en ekte plug-and-play-løsning.
«Fleksibiliteten reduserer behovet for flere pumpemodeller i pleiemiljøet», sier Henrik. «Systemet er lett å sette opp og betjene, og det innebygde batteriet gir uavbrutt behandling også når pumpen ikke er koblet til et strømuttak.»
Han fortsetter: «Sammen med vårt utvalg av mansjetter er systemet komfortabelt for pasienten, brukervennlig for helsepersonellet og klinisk effektivt for levering av intermitterende pneumatisk kompresjon – noe som bidrar til bedre etterlevelse for alle som er involvert i pasientpleien.»
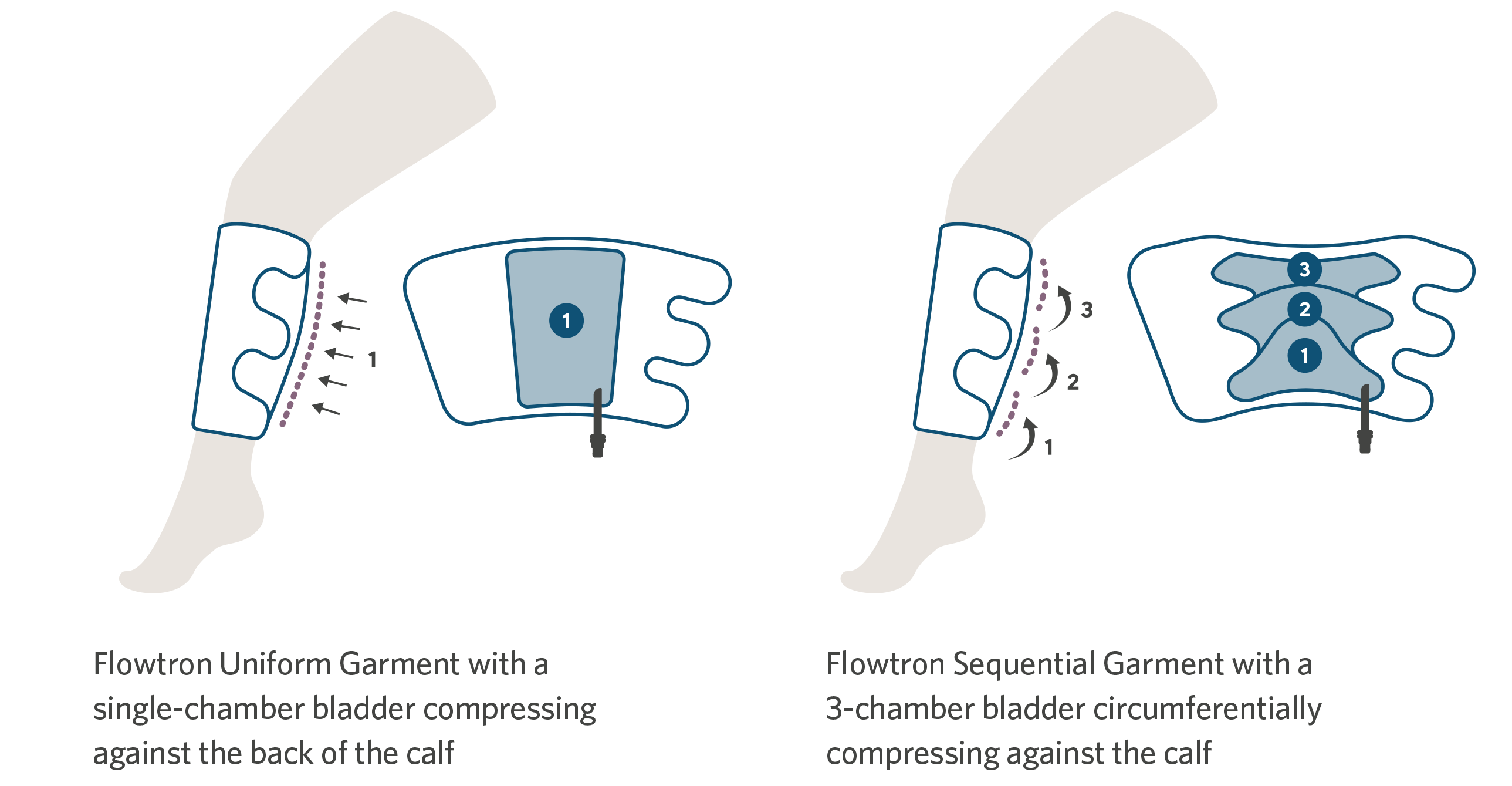
For brukervennlighet, finnes det et utvalg av Flowtron mansjetter, med versjoner som dekker legg- eller lårlengde, og som gir enten sekvensiell eller ensartet kompresjon. Disse er tilgjengelig ulike størrelser fra liten til bariatrisk. Fotkompresjon er tilgjengelig i normal eller stor fotstørrelse. En kombinasjon av forskjellige mansjetter kan brukes samtidig. Valg av mansjett avhenger rett og slett av hva legen foretrekker.
Henrik Runnerström forklarer: «Internasjonale retningslinjer anbefaler kontinuerlig behandling i 18–24 timer i døgnet8. Studier viser en direkte sammenheng mellom komfortnivået og pasientens vilje til å bruke mansjettene over lengre perioder9. Vi har som mål å forbedre pasientkomforten ved å bruke pustende materialer, som bidrar til å holde pasienten tørr og avkjølt ved å la varme og fuktighet passere gjennom.»
Les mer om Flowtron aktivt kompresjonssystem her
Flowtron IPC – kliniske data
Laboratoriestudier
Mange av de tidlige undersøkende studiene som underbygger intermitterende pneumatisk kompresjon som en generisk form for VTE-profylakse, ble gjennomført ved bruk av forgjengeren til dagens Flowtron-system. Selv om teknologien er oppdatert, forblir de underliggende designprinsippene de samme, som syklustrykk, oppblåsingshastighet og syklusintervaller.
Blant studier som viser den antitrombotiske og profibrinolytiske effekten av IPC, tyder viktige funn på at IPC gjør koageldannelse mindre sannsynlig. I tillegg øker IPC også suppresjonen av koageldannelsen og bryter ned koagelene når de begynner å utvikle seg.7
De viktigste funnene i disse studiene var at IPC reduserer sannsynlighet for dannelse av blodpropp, samtidig som det øker suppresjonen av blodproppdannelsen og bidrar til å bryter ned blodpropper når de begynner å utvikle seg.
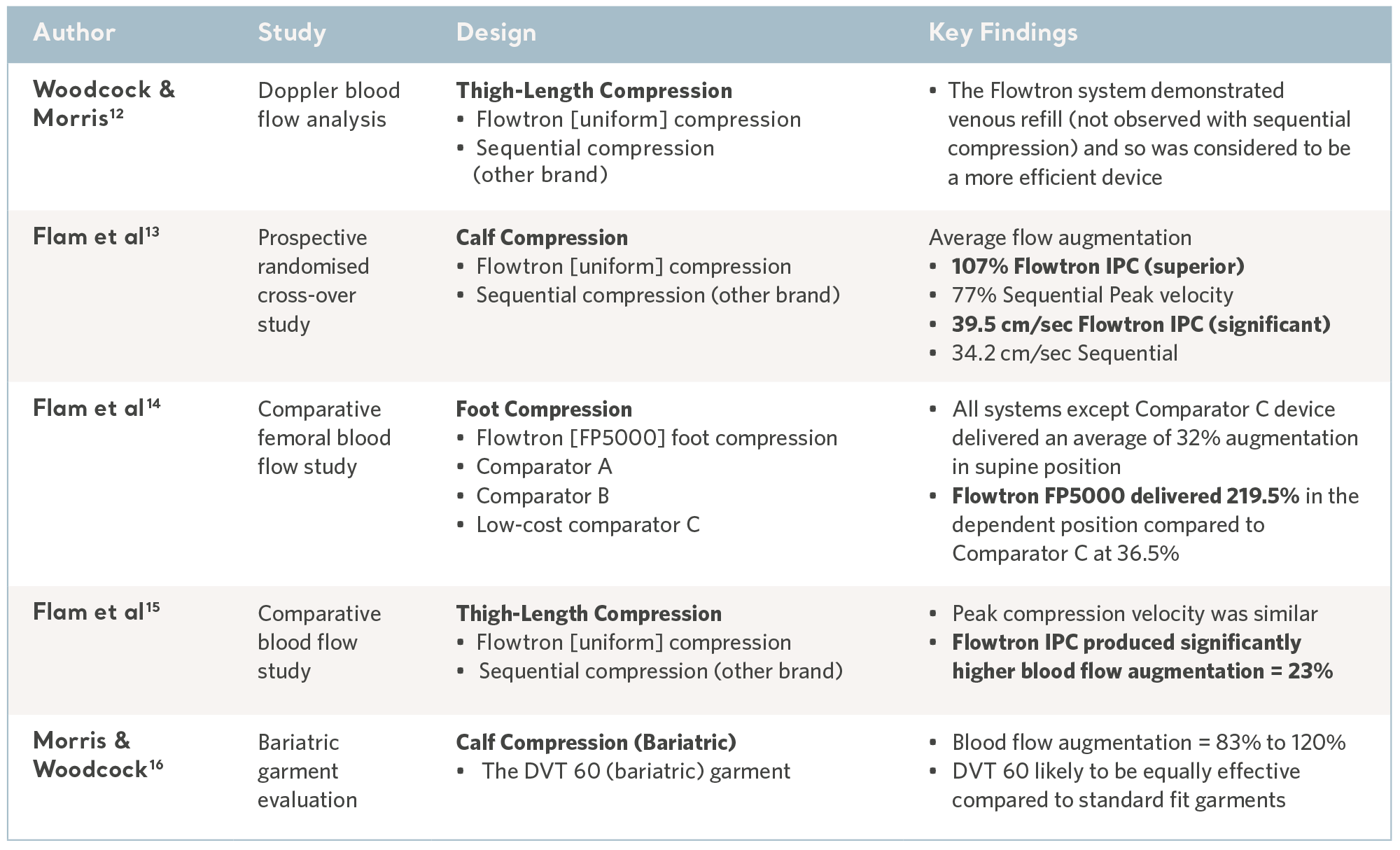
Sammenlignbare studier av blodsirkulasjon
Å reversere venøs stase er avgjørende for forebygging, og Flowtron IPC-serien har gjennomgått en rekke komparative laboratorietester og konsekvent vist positive resultater10,11. Se tabellen nedenfor.
Dokumentasjon fra laboratoriet
Klinisk effekt
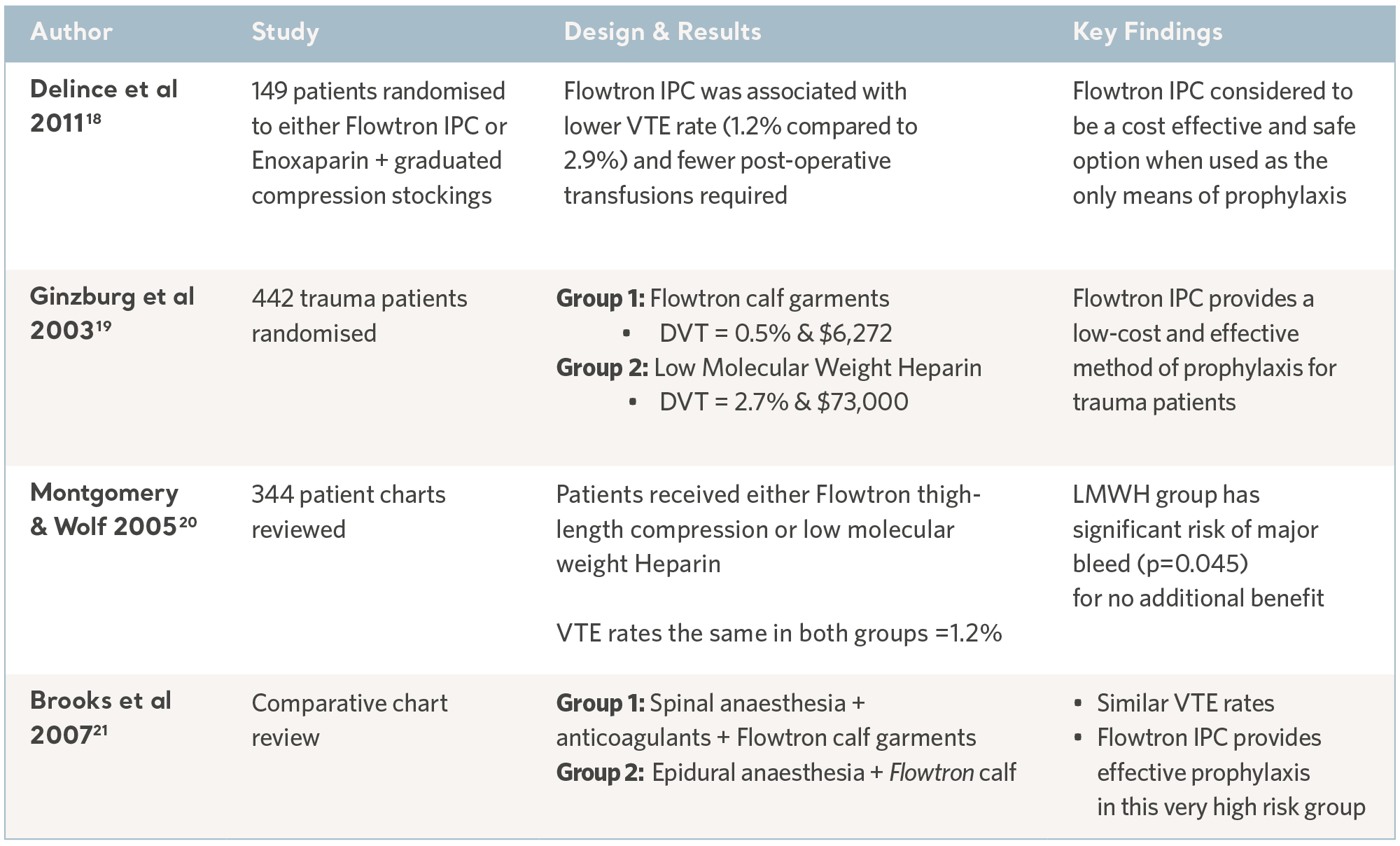
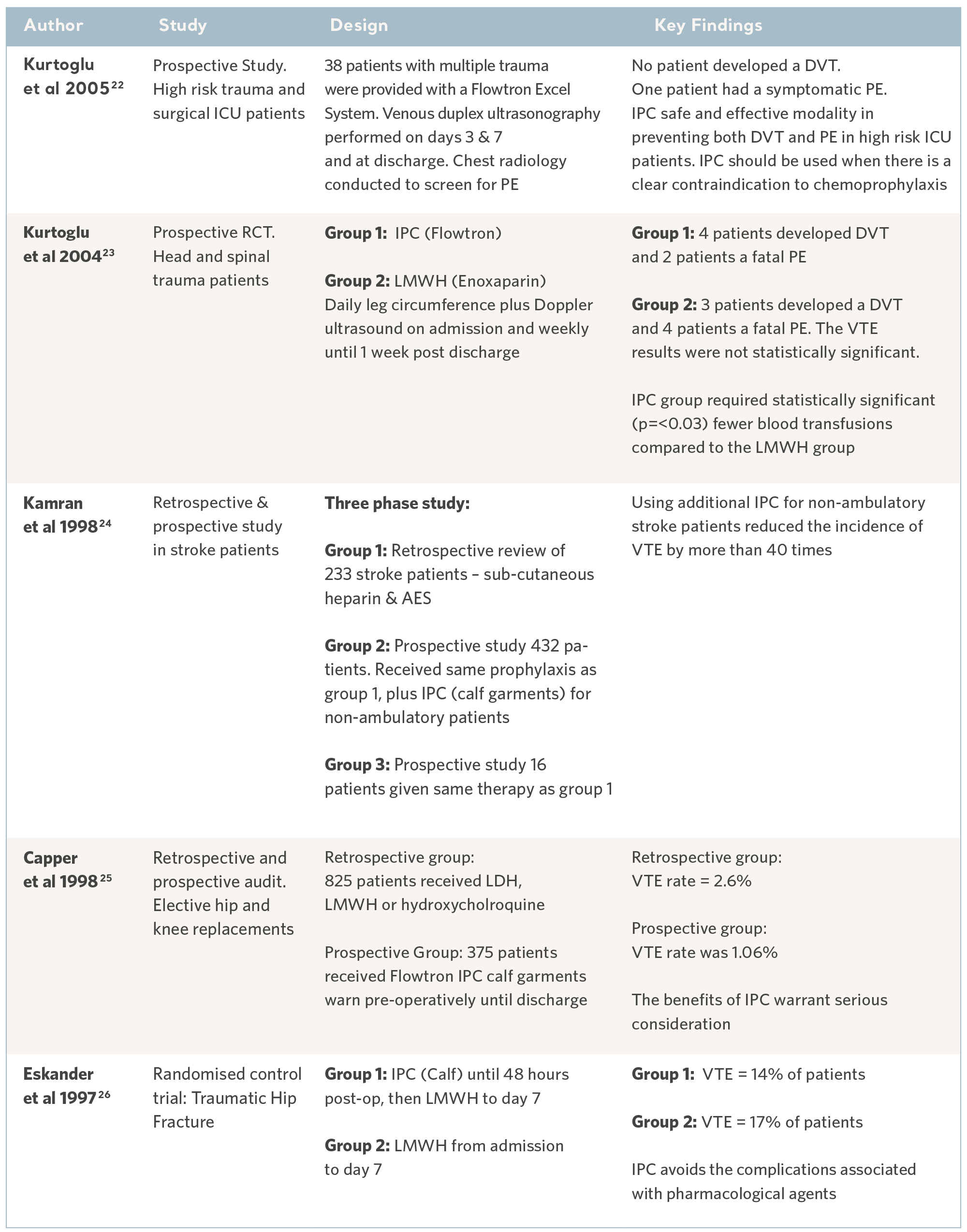
De siste 30 årene er en rekke kliniske studier utført av uavhengige spesialister. Forsøkspersoner er rekruttert fra pasientpopulasjoner med høyest risiko og på tvers av en rekke kliniske spesialiteter. Resultatene har konsekvent demonstrert den profylakse kapasiteten til produktene i Flowtron IPC-serien når de brukes med, eller i stedet for, andre metoder for profylakse. Selv om IPC nå er bredt akseptert som en gyldig form for profylakse, har disse eldre studiene fortsatt verdi17. Se tabellene nedenfor.
Kliniske studier med Flowtron
Flowtron-evidens i spesialgrupper
IPC-evidens fra metaanalyser og systematiske gjennomganger
Som med alle forebyggende tiltak, kan IPC bare være effektiv hvis det brukes på riktig pasient til riktig tid, og det betyr å identifisere risikopasienter før en VTE-hendelse oppstår.
Samtidig må risikoen for bivirkninger vurderes, spesielt risikoen for blødning forbundet med bruk av antikoagulanter.
Metaanalyser og systematiske gjennomganger, der flere evidenskilder er kombinert for å bestemme den samlede kliniske nytten av IPC, er nyttige informasjonskilder og kan fungere som veiledning ved forskrivning.
I tillegg til den systematiske gjennomgangen er det publisert nasjonale og internasjonale retningslinjer for klinisk praksis som oversetter solid og moderne forskning til konkrete anbefalinger; kunnskapshull fylles av internasjonale konsensuspaneler. Selv om ordlyden varierer, er anbefalingene i stor grad konsistente, og alle aksepterer IPC som en effektiv og sikker intervensjon. Se tabellen nedenfor.
IPC-evidens fra systematiske gjennomganger
Brukervennlighet
Som med enhver form for profylakse, er IPC bare fordelaktig når det blir riktig administrert og tolerert av pasientene som bruker det. Komfort og brukervennlighet er viktige faktorer, og samsvar kan variere.30
Utstyrets intuitive brukergrensesnitt og riktige sikkerhetsfunksjoner er en fordel for å minimere risikoen for skade i travle pleiemiljøer. Noen av disse aspektene er evaluert i utprøvinger av brukervennligheten og i uavhengige teknologiske vurderinger. Disse egenskapene inkluderer sikkerhet, kvalitet, brukervennlighet i tillegg til kostnadseffektivitet. Se tabellen nedenfor.
Evidens fra studier av brukervennlighet 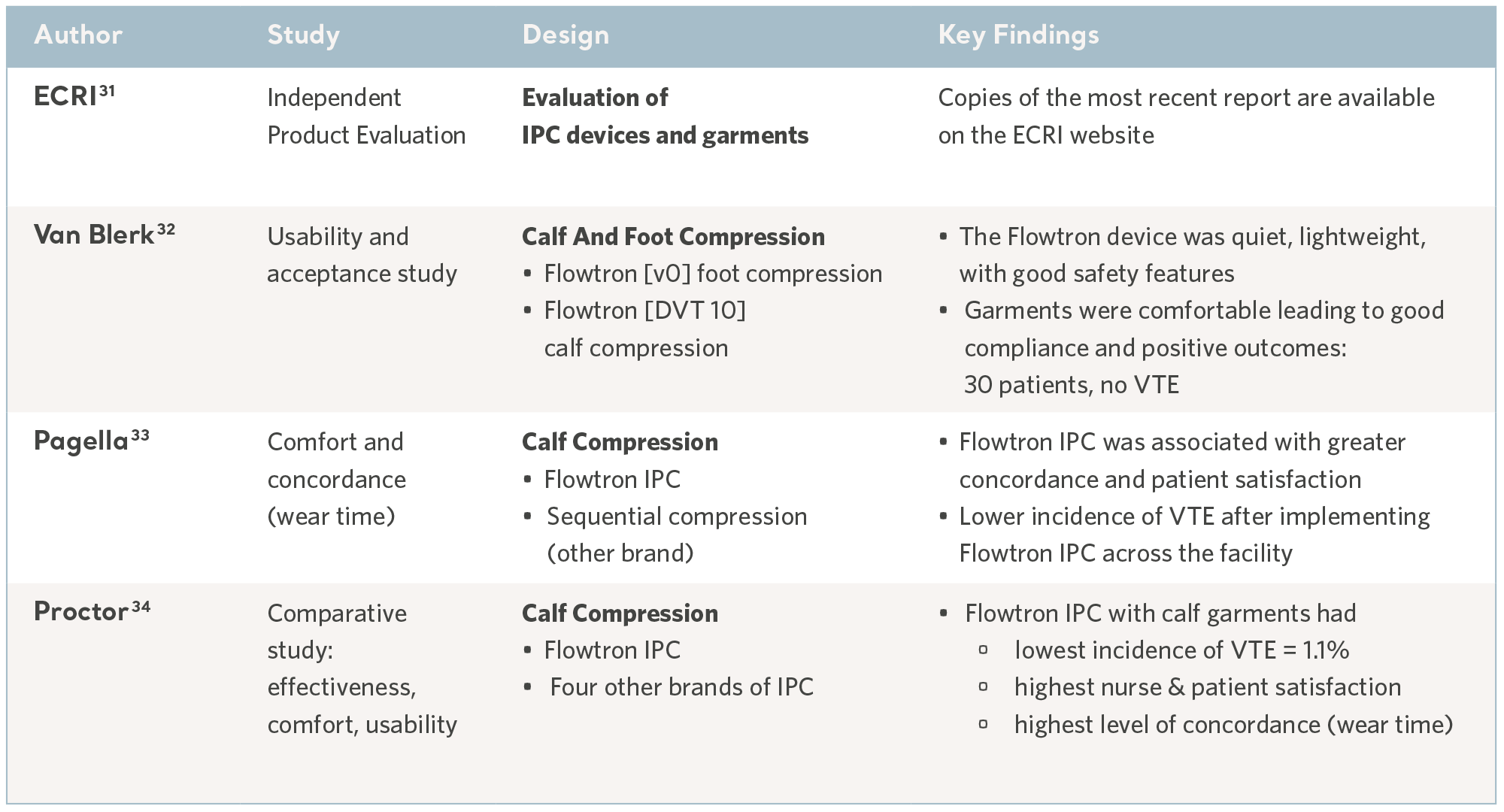
Les mer om kliniske data om Flowtron IPC
Referanser
1- Beckman MG, Hooper WC, Critchley SE et al. Venous thromboembolism: a public health concern. Am J Prev Med. 2010; 38(4): S495-501.
2- Nelzen O, Bergqvist D, Lindhagen A. Leg ulcer etiology - a cross sectional population study. J Vasc Surg. 1991; 14: 557-64 cited in Nicolaides A, Fareed J, Kakkar A et al. Prevention and treatment of venous thromboembolism - International Consensus Statement. International Angiology. 2013; 32(2): 111-260.
3- Ruppert A, Steinle T, Lees M. Economic burden of venous thromboembolism: a systematic review. J Med Econ. 2011; 14(1): 65-74
4- Prevention and treatment of venous thromboembolism. Heart.org. https://www.heart.org/en/health-topics/venous-thromboembolism/prevention-andtreatmentof-venous-thromboembolism-vte. Sist nedlastet i desember 2019.
5- Jha AK, Larizgoitia I, Audera-Lopez C et al. The global burden of unsafe medical care: analytic modelling of observational studies. BMJ Qual Saf 2013; 22: 809-15.
6- Reitsma PH, Versteeg HH, Middeldorp S. Mechanistic view of risk factors for venous thromboembolism. Arteriosclerosis, thrombosis and vascular biology. 2012; 32(3): 563-8.
7- Nicolaides A, Fareed J, Kakkar A et al. Prevention and treatment of venous thromboembolism - International Consensus Statement. International Angiology. 2013;32(2): 111-260.
8- Guyatt GH, AKL EA, Crowther M et al. Executive Summary: Antithrombotic Therapy and Prevention of Thrombosis. 9. utgave. American College of Chest Physicians. Evidence-Based Clinical Practice Guidelines. Chest. 2012; 141(2):7S-47S.
9- Pagella P, Cipolle M, Sacco E et al. A randomised trial to evaluate compliance in terms of patient comfort and satisfaction of two pneumatic compression devices. Orthop Nurs. 2007; 26(3):169-74.
10- Morris RJ, Giddings JC, Ralis HM, et aL. Haematological and haemodynamic comparison of the Kendall AV Impulse™ and the Arjo [Huntleigh] FP5000 Intermittent Pneumatic Foot Compression System. Klinisk rapport fra Arjo, 2003.
11- Westrich G, Specht LM, Sharrock NE et al. Venous haemodynamics after total knee arthroplasty: evaluation of active dorsal to plantar flexion and several mechanical compression devices. The Journal of Bone & Joint Surgery. 1998; 80B(6): 1057-1066.
12- WoodcockJPandMorrisRJ.TheeffectoftheKendallSCDTMandArjo[Huntleigh]DVT30 garments on femoral and popliteal vein blood flow measurements. Klinisk rapport fra Arjo, 2002.
13- Flam E, Berry S, Coyle A et al. Blood flow augmentation of intermittent pneumatic compression systems used for the prevention of deep vein thrombosis prior to surgery. The American Journal of Surgery. 1996; 171(3): 312-315.
14- Flam E, Nackman G, Tarantino D et al. Intermittent pneumatic compression devices of the foot: a comparison of various systems on femoral vein blood flow velocity augmentation in the v supine and dependent, non-weight bearing positions. Klinisk rapport fra Arjo, 2000.
15- Flam E, Berry S, Coyle A et al. DVT prophylaxis: comparison of two thigh high intermittent pneumatic compression systems. Presented at the meeting of the American College of Surgeons, San Francisco. 1993.
16- Morris RJ and Woodcock JP. Intermittent pneumatic compression for bariatric patients – the DVT60 compression garment. Klinisk rapport fra Arjo, 2003.
17- Falck-Ytter Y, Francis CW, Johanson NA et al. Antithrombotic Therapy and Prevention of Thrombosis, 9. utgave: ACCP Evidence Based Clinical Practice Guidelines: Prevention of VTE in Orthopedic Surgery Patients. Chest. 2012; 141: S2.
18- Delince P. RCT of intermittent pneumatic compression (IPC) versus low molecular weight heparin (LMWH) plus anti-embolic stockings (AES) in the prevention of venous thromboembolism during elective hip and knee surgery. Am. Ass. Orth. Surg. Konferanse 2011.
19- Ginzburg E, Cohn S, Lopez J et al. Randomised clinical trial of intermittent pneumatic compression and low molecular weight heparin in trauma. British Journal of Surgery. 2003; 90: 1338- 1344.
20- Montgomery JS and Wolf JS (2005). Venous Thrombosis Prophylaxis for Urological Laparoscopy: Fractionated Heparin versus Sequential Compression Devices. The Journal of Urology. 2005; 173: 1623-1626.
21- Brooks PJ, Keramati M, Wickline A . Thromboembolism in patients undergoing total knee arthroplasty with epidural analgesia. Journal of Arthroplasty. 2007; 22(5): 641-643.
22- Kurtoglu M, Guloglu R, Ertekin C et al. Intermittent pneumatic compression in the prevention of venous thromboembolism in high-risk trauma and surgical ICU patients. Turkish Journal of Trauma & Emergency Surgery. 2005; 11(1): 38-42.
23- Kurtoglu M, Yanar H et al. Venous thromboembolism prophylaxis after head and
spinal trauma: Intermittent pneumatic compression devices versus low molecular weight heparin. World Journal of Surgery. 2004; 28(8): 807-811.
24- Kamran SI, Downey D and Ruff RL. Pneumatic sequential compression reduces the risk of deep vein thrombosis in stroke patients. Neurology. 1998; 50(6): 1683- 1688.
25- Capper C. External pneumatic compression therapy for DVT prophylaxis. British Journal of Nursing. 1998; 7(14): 851-854.
26- Eskander M, Limb D, Stone M et al. Sequential mechanical and pharmacological thrombo prophylaxis in the surgery of hip fractures. International Orthopaedics. 1997; 21: 259-261.
27- KakkosSK, Caprini JA, Geroulakos G, et al.Combined intermittent pneumatic leg compression and pharmacological prophylaxis for prevention of venous thromboembolism. Cochrane Database of Systematic Reviews. Wiley & Sonds. 2016; 9. www.cochranelibrary.com
28- Eppsteiner RW, Shin JJ, Johnson J, van Dam RM. Mechanical compression versus heparin therapy in postoperative and post trauma patients: a systematic review and meta-analysis. World Journal of Surgery. 2010; 34(1): 10-19.
29- Morris RJ, Woodcock JP. Intermittent pneumatic compression or graduated compression stockings for deep vein thrombosis prophylaxis? A systematic review of direct clinical comparisons. Annals of Surgery. 2010; 251(3): 393-6.
30- Elpern E, Killeen K, Patel G, Senecal PA. Original forskning: The Application of Intermittent Pneumatic Compression Devices for Thromboprophylaxis. AJN The American Journal of Nursing. 2013 Apr 1;113(4):30-6
31- ECRI Institute. Mars 2017 https://www.ecri.org/Pages/default.aspx
32- Van Blerk D. Evaluating an Intermittent Compression System for Thromboembolism Prophylaxis. Professional Nurse. 2004; 20(4): 48-49.
33- Pagella P, Cipolle M, Sacco E et al. A randomised trial to evaluate compliance in terms of patient comfort and satisfaction of two pneumatic compression devices.
Orthopaedic Nursing. 2007; 26(3): 169-174.
34- Proctor MC, Greenfield LJ, Wakefield TW et al. A clinical comparison of pneumatic compression devices: the basis for selection. Journal of Vascular Surgery. 2001; 34(3): 459-464.